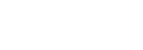摘要
免疫检查点抑制剂(ICIs)已成为晚期非小细胞肺癌(NSCLC)的一种重要治疗策略。确定可靠和方便的生物标志物来预测免疫治疗的疗效和毒性仍然是当务之急,肿瘤相关抗体(TAAbs)被认为是有希望的候选物之一。本研究纳入97例接受基于免疫检查点抑制剂的免疫治疗的晚期非小细胞肺癌患者,分为训练组(n = 48)和验证组(n = 49),测定35种肺癌相关抗体的血清水平。根据训练队列中各肺癌相关抗体血清阳性与临床结果之间的统计学相关性,建立肺癌相关抗体面板来预测无进展生存期(PFS),并在验证队列和不同亚组中进一步检查。同样,另一个肺癌相关抗体组用于推导预测免疫相关不良事件(irAEs)的发生。
01 研究背景
肺癌是最常见的癌症类型之一,在世界范围内肺癌患者死亡人数最多。死亡率高的主要原因是由于肺癌患者往往在晚期被诊断出来,缺乏有效的治疗方法。非小细胞肺癌(Non-small-cell lung cancer, NSCLC)是肺癌的主要亚型,占肺癌总数的80-85%。最近发展的基于免疫检查点抑制剂(ICI)的抗PD -1(程序性细胞死亡蛋白1)、PD-L1(程序性死亡配体1)或CTLA-4(细胞毒性T淋巴细胞相关蛋白4)单克隆抗体治疗提高了非小细胞肺癌患者5%左右的生存率,而抗PD-1/PD-L1单药治疗非小细胞肺癌的有效率仅为约15-20%。因此,有必要鉴定有价值的生物标志物来预测治疗效果并为免疫治疗提供指导。
以前的研究已经发现了肿瘤组织细胞蛋白的多样性,这些蛋白在诊断之前就已经进入体液系统并触发免疫系统产生相关抗体。这些蛋白主要包括肿瘤抑制基因蛋白如p53和p16,信使RNA (mRNA)结合蛋白如IGF2BP2,细胞周期调节蛋白如Cyclin B1和凋亡抑制蛋白如Survivin。尽管其潜在机制尚不完全清楚,但肺癌相关抗体的产生可以反映肺癌患者更高的免疫反应性和增强的免疫监测。研究人员已经证明了肺癌相关抗体作为早期肺癌诊断的血清学生物标志物以及预测免疫治疗的疗效的应用潜力。一些研究报道,NY-ESO-1、XAGE1和SIX2等肺癌相关抗体阳性表明抗PD-1单药治疗的临床疗效更好。因此,在这项研究中,我们旨在开发肺癌相关抗体组,以临床预测晚期非小细胞肺癌患者基于免疫检查点抑制剂治疗的疗效和毒性。
02 样本人群
本研究是在北京协和医院进行的单中心回顾性研究。在2017年7月至2020年9月期间被诊断为转移性或不可切除期的晚期非小细胞肺癌患者参加了该研究。
纳入标准包括:
(1)年龄≥18岁;(2)病理证实为非小细胞肺癌;(3)肺癌TNM第八版分级为IIIB/IV期;(4)接受以PD-1/PD-L1抑制剂为基础的免疫治疗。
排除标准包括:
(1)有自身免疫性疾病;(2)接受过其他免疫治疗,包括但不限于疫苗和过继细胞免疫治疗;(3)活动性多发性原发恶性肿瘤;(4)接受强化免疫抑制剂。
收集所有入组患者的临床信息,包括性别、年龄、吸烟、分期、病理和驱动基因改变。驱动基因改变包括表皮生长因子受体(EGFR)突变,间变性淋巴瘤激酶(ALK)融合,RET (RET原癌基因)融合和KRAS (Kirsten大鼠肉瘤病毒癌基因同源物)G12C突变。
本研究的主要终点是基于免疫检查点抑制剂治疗的无进展生存期(PFS),次要终点是总缓解率(ORR)和不良反应(irAEs)发生率。根据RECIST v1.1评估疗效,ORR定义为完全缓解加部分缓解(PR)。无进展生存期被定义为从开始治疗到疾病进展或任何原因死亡的时间间隔。不良反应由两名经验丰富的肿瘤学家根据中国临床肿瘤学会(CSCO)免疫治疗相关毒性管理指南进行诊断。
03 研究结果
3.1 研究人群的特征
本研究共纳入97例接受免疫检查点抑制剂治疗的晚期非小细胞肺癌患者,包括一个发现队列(n = 48)和一个验证队列(n = 49)。表1总结了基线特征。两组患者肺癌相关抗体阳性率分别为72.9%和73.9%。43例驱动基因突变患者也被纳入研究,其中20例进入发现队列,23例进入验证队列。除了发现组中使用免疫检查点抑制剂作为一线治疗的比例较高外,两组的其他临床特征,如年龄、性别、吸烟史、ECOG评分、病理、分期、治疗方案等均达到了很好的平衡。
3.2 在发现队列中确定具有预测进展价值的七种肺癌相关抗体组
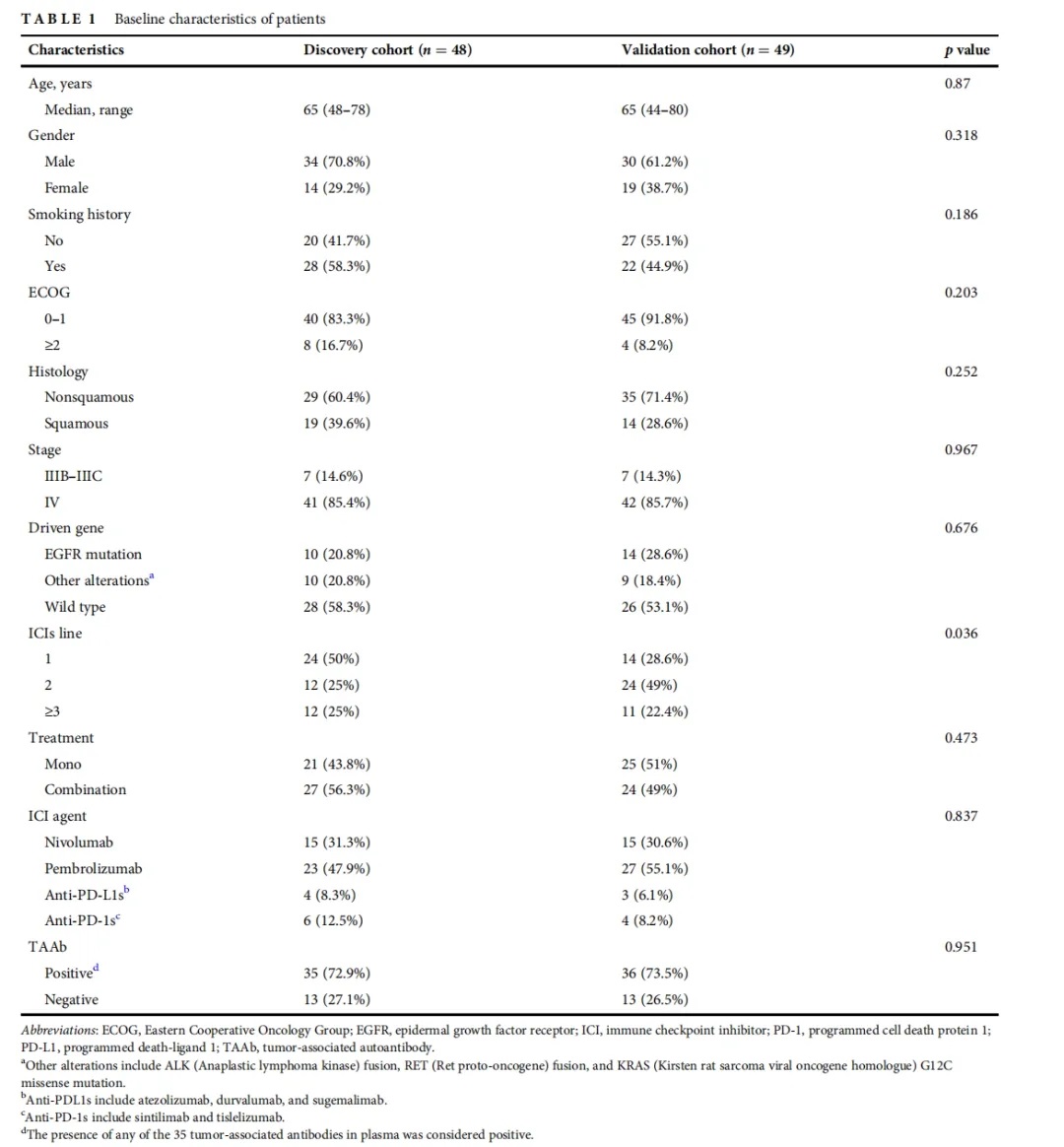
为了确定对免疫检查点抑制剂治疗效果具有最佳预测价值的肺癌相关抗体组,我们在发现队列中执行了以下程序(图1a)。首先,我们筛选了48例患者35种肺癌相关抗体的血清水平。结果显示,每种肺癌相关抗体阳性病例数为0 ~ 6例,排除无阳性病例的肺癌相关抗体(图1b)。其次,我们评估了每种肺癌相关抗体阳性病例对应的中位无进展生存期(mPFS),排除了中位无进展生存期小于4个月的肺癌相关抗体(图1c)。第三,将剩余的肺癌相关抗体设计不同的组合,通过Kaplan-Meier生存分析检验其阳性与无进展生存期的统计相关性。最后,选择由p53、CAGE、MAGEA4、GAGE7、UTP14A、IMP2和PSMC1组成的7种肺癌相关抗体组。有17例患者呈阳性,七种肺癌相关抗体阳性的患者与较好的无进展生存期显著相关(图1d)。

3.3 在验证队列中评估七种肺癌相关抗体组的性能
为了检验七种肺癌相关抗体对不同临床背景患者的预测价值,我们测量了验证队列中49例患者的7种肺癌相关抗体的血清水平(图2a)。验证队列中有19例患者检测呈阳性,阳性率为38.8%,与发现队列相似(图2b)。重要的是,该队列中七种肺癌相关抗体阳性也与更长的无进展生存期显著相关(图2C)。分析显示,七种肺癌相关抗体阳性是无进展生存期的独立预测因子,结果阳性的患者与结果阴性的患者相比,在接受免疫检查点抑制剂治疗后疾病进展的风险增加了0.417倍。在包括发现和验证队列在内的总体人群中,肺癌相关抗体阳性患者的免疫治疗疗效优于肺癌相关抗体阴性患者,表现出更长的无进展生存期(图2D)和更高的客观缓解率(图2e)。
3.4 评估七种肺癌相关抗体在不同亚组人群中的预测价值
除了对一般非小细胞肺癌患者的预测价值外,我们还对七种肺癌相关抗体在不同临床特征分类的不同亚组患者中的表现感兴趣。在接受免疫检查点抑制剂单药治疗的患者亚组中,七种肺癌相关抗体阳性患者的无进展生存期更长(图3a)。此外,七种肺癌相关抗体也是预测免疫治疗联合化疗的疗效的良好生物标志物(图3b)。此外,后线接受免疫检查点抑制剂治疗的小组阳性患者的无进展生存期明显长于阴性患者(图3C)。在一线免疫检查点抑制剂治疗的患者中也观察到类似的趋势(图3D)。在组织病理学方面,亚组分析显示,七种肺癌相关抗体组在鳞状细胞癌患者中效果更好(图3e),而在非鳞状细胞癌亚组中无统计学差异(图3f)。此外,对于没有驱动突变的患者,七种肺癌相关抗体阳性与更长的无进展生存期显著相关(图3g),并且在驱动突变亚组中也观察到这种关联(图3h)。总体而言,在每个亚组内比较中,七种肺癌相关抗体阳性始终与更长的无进展生存期相关(图3I)。

3.5 确认四种肺癌相关抗体可预测免疫治疗不良反应
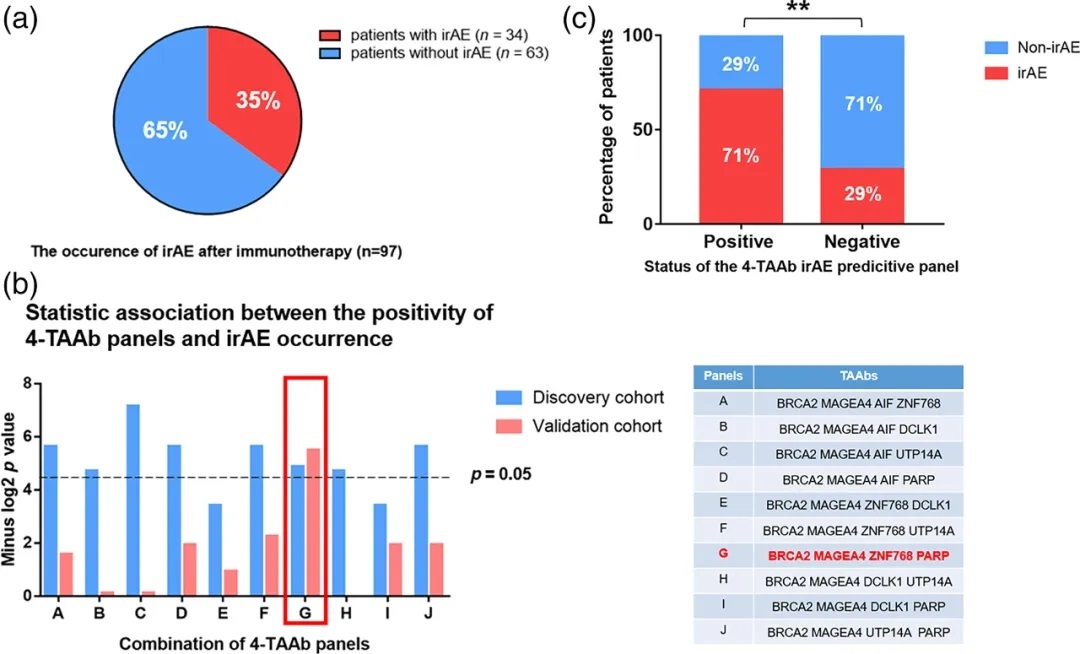
所有纳入本研究并随访6个月以上的患者(n = 97),免疫治疗不良反应发生率为35%(图4a)。我们发现,在发现队列中,只有BRCA2的单一肺癌相关抗体与免疫治疗后不良反应的发生有统计学意义的关联。因此,应该开发一组具有预测价值的肺癌相关抗体,而不是单一肺癌相关抗体来预测免疫治疗不良反应的发生率。
相应的开发程序如下:(1)选择p值最小的肺癌相关抗体BRCA2和MAGEA4;(2)从另外5个p值相对较小的肺癌相关抗体中选择2个与BRCA2和MAGEA4组合,形成不同的四种肺癌相关抗体组合。检验每个抗体组合阳性与免疫治疗不良反应发生之间的统计学关联,只有一个肺癌相关抗体组合(BRCA2、MAGEA4、ZNF768和PARP)在发现和验证队列中都表现出显著的相关性(图4b)。分析显示,该面板是免疫治疗后不良反应发生的独立预测因子,阳性结果患者免疫治疗后不良反应发生的风险是阴性结果患者的6.146倍(图4c)。
04 研究结论